| Главная » Статьи » Сортировка материалов по секциям » Педагогические науки |
Общая педагогика и история педагогики
|
Некоторые методические рекомендации по реализации элективных курсов по основам химического анализа
Автор: Мельник Анатолий Алексеевич, кандидат педагогических наук, Учебный центр ЗАО «Крисмас+»
В настоящее время появляется довольно много элективных курсов по изучению основ химического анализа. Программой предусмотрено решение расчётных задач. Для того чтобы учителю затратить минимум времени на подготовку к занятиям, можно предложить так называемые матрицы для составления расчётных задач. Приведём конкретные примеры.
В теме «Аналитическая химическая реакция» расчеты производятся по формуле, которая связывает между собой открываемый минимум соли (m), предельное разбавление (Vпр), минимальный объём (Vmin). Фрагмент матрицы будет выглядеть так:
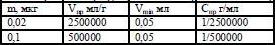
Условия расчётных задач будут выглядеть следующим образом:
1.Вычислить открываемый минимум соли (m), если предельное разбавление (Vпр) равно ______ мл/г , а минимальный объём (Vmin) равен ______ мл.
2.Вычислить открываемый минимум соли (m), если предельная (минимальная) концентрация (Cпр) равна ______ г/мл, а минимальный объём (Vmin) равен ______ мл.
3.Вычислить минимальный объём раствора соли (Vmin), если известно, что открываемый минимум (m) равен ____ микрограмм, а предельное разбавление (Vпр) равно _____ мл/г.
4.Вычислить минимальный объём раствора соли (Vmin), если известно, что открываемый минимум (m) равен ____ микрограмм, а предельная (минимальная) концентрация (Cпр) равна ______ г/мл.
5.Вычислить предельное разбавление (Vпр) и предельную (минимальную) концентрацию (Cпр), если открываемый минимум (m) равен ______ микрограмм, а минимальный объём раствора (Vmin) равен ______ мл.
Изучая тему «Буферные растворы», учащиеся решают расчётные задачи на примере конкретных буферных растворов: ацетатного, аммиачного, карбонатного, формиатного, фосфатного. В расчётных задачах необходимо вычислить рН буферного раствора в зависимости от количественного соотношения компонентов. Приведём примеры.
Ацетатный буферный раствор CH3COOH + CH3COONa
Вычислить рН ацетатного буферного раствора, содержащего в 1 литре ____моль CH3COOH и ____моль CH3COONa. рК (CH3COOH)= 4,75
Фрагмент матрицы будет выглядеть так:

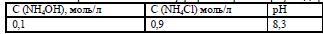
Аммиачный буферный раствор NH4OH + NH4Cl
Вычислить рН аммиачного буферного раствора, содержащего в 1 литре _____моль NH4OH и ____моль NH4Cl. рК (NH4OH)= 4,75
Формиатный буферный раствор HCOOH + HCOONa
Вычислить рН формиатного буферного раствора, содержащего в 1 литре _____моль HCOOH и ____моль HCOONa. рК (HCOOH)= 3,75

Карбонатный буферный раствор Na2CO3 + NaHCO3
Вычислить рН карбонатного буферного раствора, содержащего в 1 литре _____моль NaHCO3 и ____моль Na2CO3. рК II(Н2СО3)= 10,33

Фосфатный буферный раствор Na2HРO4 + NaН2РO4
Вычислить рН фосфатного буферного раствора, содержащего в 1 литре _____моль Na2HРO4 и ____моль NaН2РO4. рК II(Н3РО4)= 7,21

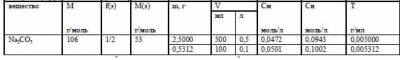
В теме «Вычисление концентрации вещества в растворе» учащиеся должны вычислять молярную концентрацию (См), нормальную концентрацию (Сн) и титр (Т) раствора вещества по массе навески и объёму раствора, а также вычислять массу навески, которую нужно взять для приготовления раствора заданной концентрации. Все эти данные связывает между собой матрица, фрагмент которой приведён ниже:
Условия расчётных задач будут выглядеть следующим образом:
1.Вычислить молярную концентрацию (См), нормальную концентрацию (Сн) и титр (Т) раствора вещества ______ , если из его навески (m) ______ г приготовили раствор объёмом (V) _______ мл.
2.Какую навеску (m) вещества _______ необходимо взять для приготовления раствора с молярной концентрацией (См) ________ моль/л объёмом (V) ______ мл.
3.Какую навеску (m) вещества _______ необходимо взять для приготовления раствора с нормальной концентрацией (Сн) ________ моль/л объёмом (V) ______ мл.
4.Какую навеску (m) вещества _______ необходимо взять для приготовления раствора с титром (Т) ________ г/мл объёмом (V) ______ мл.
5.У вещества ______ определить фактор эквивалентности f(э) и молярную массу эквивалента Мэ.
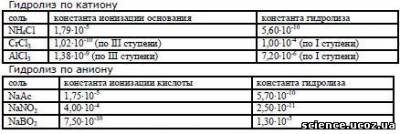
В теме «Равновесие в растворах гидролизующихся солей» учащиеся вначале должны определить тип гидролиза (по катиону, по аниону, по катиону и аниону), и вычислить по расчётным формулам степень гидролиза (h) и рН раствора гидролизующейся соли.
Хлорид аммония – соль, гидролизующаяся по катиону. Для вычисления степени гидролиза (h) и рН раствора необходимо знать константу ионизации гидрата аммиака и концентрацию раствора соли. Фрагмент матрицы приведён ниже. Условие задачи будет выглядеть так: Вычислить степень гидролиза (h) и рН раствора хлорида аммония NH4Cl, если концентрация раствора (С) равна ______ моль/л, константа ионизации Кион (NH4ОН)= 1,79·10-5, рК=4,75.

Нитрит калия – соль, гидролизующаяся по аниону. Для вычисления степени гидролиза(h) и рН раствора необходимо знать константу ионизации азотистой кислоты и концентрацию раствора соли. Фрагмент матрицы приведён ниже. Условие задачи будет выглядеть так: Вычислить степень гидролиза (h) и рН раствора нитрита калия KNO2, если концентрация раствора (С) равна ______ моль/л, константа ионизации Кион (HNO2)= 4,0·10-4, рК=3,4.

При изучении этой темы предусмотрено вычисление константы гидролиза по значению константы ионизации основания (при гидролизе по катиону), константы ионизации кислоты (при гидролизе по аниону). Условия расчётных задач будут выглядеть следующим образом:
Определить тип гидролиза и вычислить константу гидролиза, если константа ионизации равна _____ .
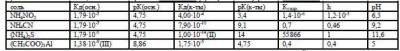
Есть соли, гидролизующиеся по катиону и аниону одновременно (нитрит аммония, NH4NO2, цианид аммония NH4CN, сульфид аммония (NH4)2S, ацетат алюминия(CH3COO)3Al). Для вычисления константы гидролиза (Кгидр.), степени гидролиза (h) и рН раствора соли необходимо знать константу ионизации основания, рК (основания), константу ионизации кислоты, рК (кислоты). Фрагмент матрицы приведён ниже. Условие задачи будет выглядеть так: Вычислить константу гидролиза (Кгидр.), степень гидролиза (h) и рН раствора соли ______ , если константа ионизации основания равна ________ , рК (основания) равна _______ , константа ионизации кислоты равна ________ , рК (кислоты) равна ________ .
В теме «Комплексные соединения» изучается диссоциация этих соединений и решаются задачи на вычисление концентрации продуктов диссоциации конкретного комплексного соединения. Фрагмент матрицы приведён ниже. Условие задачи будет выглядеть так: Вычислить концентрацию каждого из продуктов диссоциации в растворе комплексного соединения _______ концентрацией _________ моль/л. Константа нестойкости (Кнест) равна _______ .
[Cu(NH3)4](OH)2 Кнест = 2,1·10-13
[Cu(NH3)4](OH)2 ® [Cu(NH3)4]2+ + 2OH-
[Cu(NH3)4]2+ « Cu2+ + 4NH30

В теме «Равновесие в системе "раствор-осадок”» решаются расчётные задачи на вычисление произведения растворимости, растворимости и концентрации ионов труднорастворимого вещества. Фрагмент матрицы приведён ниже. Условия расчётных задач будут выглядеть следующим образом:
Вычислить произведение растворимости (ПР) труднорастворимого вещества _______, если его растворимость (Р) равна _______ моль/л.
1.Вычислить растворимость (Р) труднорастворимого вещества _______, если произведение растворимости его равно ________ .
2.Вычислить растворимость (Р) труднорастворимого вещества _______ и найти концентрацию каждого иона (в моль/л), если произведение растворимости ПР равно ________ .
Кроме решения расчётных задач, программой предусмотрены лабораторные работы. Хотелось бы обратить внимание на лабораторные работы «Буферные растворы» и «Равновесие в системе раствор- осадок».
Карбонатный буферный раствор.
Приготовление карбонатного буферного раствора.
а). Приготовить 0,1М раствор карбоната натрия и 0,1М раствор гидрокарбоната натрия объёмом по 250 мл. Для этого предварительно вычислить массы твёрдых солей, на технических весах взвесить соли и растворить их в мерных колбах на 250 мл.
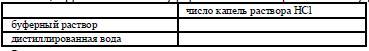
б). В 3 пронумерованные колбы объёмом 200 мл с помощью мерных цилиндров налить полученные растворы в объёмах, указанных в таблице:
Таблица. Приготовление карбонатных буферных растворов.
Вычислить значения рН полученных растворов.
в)Приготовить 9 пронумерованных пробирок и отлить по 1 мл полученных растворов:
из колбы № 1- в пробирки № 1, 4 и 7,
из колбы № 2- в пробирки № 2, 5 и 8,
из колбы № 3- в пробирки № 3, 6 и 9.
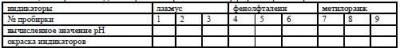
К этим растворам добавить по 2-3 капли индикаторов:
Лакмус - в пробирки № 1, 2 и 3,
Фенолфталеин - в пробирки № 4, 5 и 6,
Метилоранж - в пробирки № 7, 8 и 9.
Наблюдается ли различие в окраске растворов в пробирках:
а)№ 1, 2 и 3,
б)№ 4, 5 и 6,
в)№ 7, 8 и 9 ?
Объяснить окраску индикаторов, исходя из вычисленных значений рН растворов и интервалов перехода окраски индикаторов (см. таблицу границы перехода окраски индикаторов). Результаты данного опыта занести в таблицу:
Таблица. Окраска индикаторов в карбонатном буферном растворе.
Свойства буферных растворов.
а). Действие кислот.
В пробирки № 1, 4 и 8 добавить по 3 капли разбавленного раствора соляной кислоты, пробирки встряхнуть. Изменился ли цвет растворов? Сделать выводы.
б). Действие щелочей.
В пробирки № 3, 6 и 9 добавить по 3 капли разбавленного раствора щёлочи, пробирки встряхнуть. Изменился ли цвет растворов? Сделать выводы.
в). Буферная ёмкость.
Взять 2 колбы на 50 мл, в одну из них налить 10 мл буферного раствора, полученного в колбе № 2 в опыте 1б, а в другую колбу на 50 мл налить 10 мл дистиллированной воды. В каждую колбу добавить по 2 капли фенолфталеина (в колбу с дистиллированной водой добавить каплю раствора щёлочи, чтобы окраска растворов была одинаковой). В каждую колбу с помощью аптечной пипетки по каплям добавлять разбавленный раствор соляной кислоты при постоянном перемешивании до исчезновения окраски (капли не должны попадать на стенки колбы). В каждом случае считать число капель. Результаты занести в таблицу 4, объяснить наблюдаемые явления, сделать выводы.
Таблица. Доказательство буферных свойств карбонатного буферного раствора.
Равновесие в системе раствор-осадок.
Превращение одних труднорастворимых соединений в другие.
Опыты с солями серебра
Получить осадки Ag2CrO4 и AgBr, отметить их цвет. К осадку Ag2CrO4 добавить несколько капель раствора KBr, а к осадку AgBr добавить несколько капель раствора K2CrO4. Что наблюдаете? Объяснить наблюдаемые изменения, используя значения растворимости труднорастворимых соединений. Написать уравнения реакций, указать направление их протекания.
Опыты с солями свинца
Получить осадки PbCrO4 и PbF2, отметить их цвет. К осадку PbCrO4 добавить несколько капель раствора NaF, а к осадку PbF2 добавить несколько капель раствора K2CrO4. Что наблюдаете? Объяснить наблюдаемые изменения, используя значения растворимости труднорастворимых соединений. Написать уравнения реакций, указать направление их протекания.
Литература
1. Астафуров В.И. Основы химического анализа. М.:П,1977-160с.
2. Жаркова Г.М., Петухова Э.Е. Аналитическая химия. Качественный анализ. СПб:Химия,1993-320с.
3. Неймарк А.М. Методика преподавания основ химического анализа. М.:П,1973-126с.
|
|
|
|
|
| Просмотров: 1234 | Рейтинг: 5.0/1 |
| Всего комментариев: 0 | |